現在日本で使われている薬剤
核酸系逆転写酵素阻害剤
逆転写酵素の立体構造 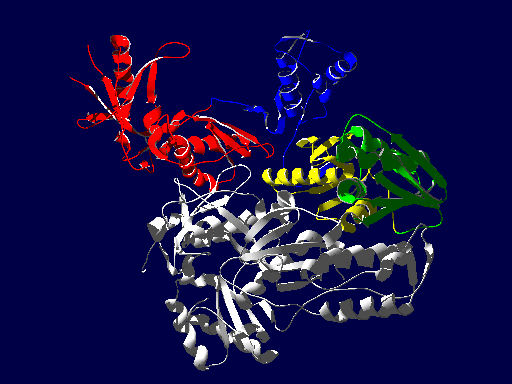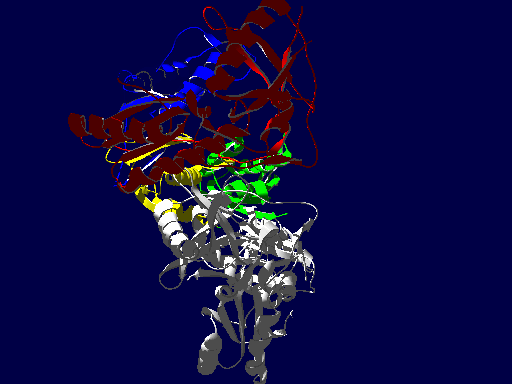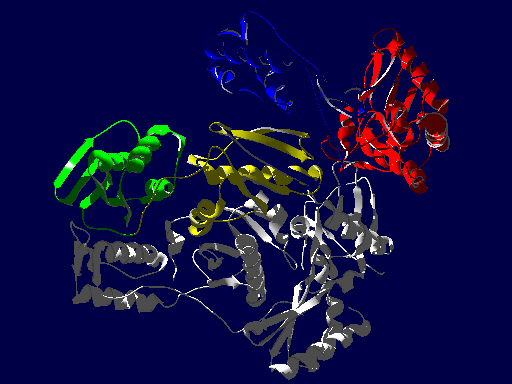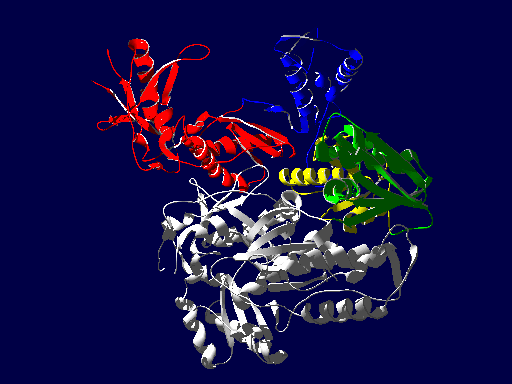
核酸系逆転写酵素阻害剤(NRTI=Nucleoside Analogue Reverse Transcriptase Inhibitor)は、最初に実用化された抗HIV-1薬剤クラスである。
- zidovudine(AZT、またはZDV)
- didanosine(ddI)
- lamivudine(3TC)
- stavudine(d4T)
- abacavir(ABC)
- tenofovir(TDF)
- emtricitabine(FTC)
<合剤>
- epzicom(EPZ)(lamivudine+abacavir [3TC+ABC])
- truvada(TVD)(tenofovir+emtricitabine [TDF+FTC])
- combivir(CBV)(zidovudine+lamivudine [AZT+3TC])
- descovy(DVY)(tenofovir alafenamide+emtricitabine [TAF+FTC])
このクラスの薬剤はnucleosideを模倣したものであり、構造式をみるといずれの化合物も、DNA伸長の際の基質となる2’-deoxyribose 3’位のOH基が欠損または置換されている。
阻害機序は細胞内で三リン酸を付与され逆転写の際に、本来の2’-deoxynucleotide-5’- triphosphateの代わりにDNAに取り込まれることによる伸長反応の停止(chain termination)である。
NRTIは多剤併用療法の柱となる重要な位置付けの薬剤であるが、多剤併用療法以前から単剤もしくは2剤療法として用いられてきたために、NRTI耐性を獲得した症例が多数認められている。
特にAZT耐性変異を獲得している症例の頻度は高く、このような症例を救済するために、交叉耐性の無い新薬開発が求められてきた。
その意味において2004年に認可されたTDFは他のNRTIと一線を画す特徴を持っている。TDFは2’-deoxyriboseがacyclic nucleoside phosphonate(ANP)に置換された構造を持つ。
ANP構造を持った抗ウイルス剤の歴史は意外と古く、1980年代後半にはすでにEBに対する阻害効果が確認されている。
その後、この構造を持つ類縁化合物が多くのherpes virusおよびretrovirusに対しても効果を示すことが明らかにされた。特に[R]-9-[2-phosphonylmethoxypropyl]adenine(PMPA)はretrovirusとhepadnavirusに作用する化合物として見出された。
PMPAはSIVを用いたin vitro実験で優れた阻害効果を実証したが、これは薬剤を注射により投与した場合の結果であり、PMPAは低い経口吸収性のために実用化されるまでに時間が費やされた。
その後、経口吸収性を大幅に改善したプロドラッグbis(isopropyloxycarbonyloxymethyl)-PMPA(bis[POC]-PMPA)が完成し、7番目のNRTIとして登場してきた。TDFには他のNRTIと異なる次のような特徴を持っている。
- nucleotidaseあるいはesterase等により分解されなくなり、生体内において長時間安定した血中濃度を維持することが可能となった。
- 他のNRTIと異なる機序で細胞内に取り込まれる。Dipyridamoleで細胞内取り込みが阻害されないことから、TDFはnucleoside carrier pathwayとは異なる別のルートで細胞内に取り込まれると推測される。
- すでにリン酸が1つ付与された構造をしており(TDFは正確にはnucleotide analogueである)、他のNRTIでは薬理効果発現の律速となっている最初のリン酸化反応をスキップして、2リン酸の付与だけで阻害活性を呈することが出来る。
- さらにいったん取り込まれたTDFは、AZT耐性変異の機序として知られているexcisionの標的となりにくいことが明らかにされている。これはTDFがAZT耐性とは交叉しないことを意味している。
- さらに好都合なことに、TDFで誘導される耐性変異K65Rは、AZT耐性変異T215Yと基本的に排他的な関係にあることが報告されている。このことからTDFはfirst lineの薬剤としてだけでなく、AZT耐性獲得症例のサルヴェージ療法の切り札としても使用されている。
近年ではTDFのプロドラッグとして、テノフォビルアラフェナミド(TAF)が新たに承認された。TAFの耐性プロファイルはTDFと同じである。
TAFは血漿中で安定であり標的細胞への移行も良好であるため、投与量を減らすことができ、TDFの副作用であった腎臓や骨に対する影響が少ないとされている。
非核酸系逆転写酵素阻害剤
非核酸系逆転写酵素阻害剤(NNRTI=Non-Nucleoside Reverse Transcriptase Inhibitor)も、その名が示すとおり逆転写酵素を阻害する薬剤である。
- nevirapine(NVP)
- efavirenz(EFV)
- delavirdine(DLV)
- etravirine(ETR)
- rilpivirine(RPV)
<合剤>
- complera(CMP)(rilpivirine+tenofovir+emtricitabine[RPV+TDF+FTC])
NNRTIの構造をみると、先に記載したNRTIとは全く異なる構造をしており、逆転写酵素の阻害機序も大きく異なっている。
NNRTIはpalmと呼ばれる逆転写酵素の活性中心部近傍に結合し、酵素活性中心であるAsp110、Asp183とAsp185の位置をずらし、ひずみを作り出すことにより逆転写活性を失活させてしまう。
第1世代非核酸系逆転写酵素阻害剤(NVP、EFV、DLV)
薬剤の化合物は構造式ではかなり異なっているが、結合した状態では類似しており、蝶がはねを広げたような形にたとえられている。結合した形状が類似していることは、既存の3薬剤間の交叉耐性が著しいことを意味している。
結合形式から大きく次の2つのタイプに分けることが出来る。
- tight-binding inhibitor:薬剤がRTに結合すると外れない薬剤であり、EFVがこの対応に該当する。Tight-binding inhibitorは、HIVの感染予防に用いる殺菌剤としての使用が検討されている。
- rapid equilibrium inhibitor:薬剤は可逆的にRTに結合しており、RTと薬剤が結合している側に極端に平衡が偏っているために抗HIV-1効果を呈するが、殺菌剤としては作用しない薬剤である。NVPとDLVがこのタイプになる。
第2世代非核酸系逆転写酵素阻害剤(ETR、RPV)
diarylpyrimidine(DAPY)アナログであるETR、RPVは、ねじれによる柔軟性(wiggling)と揺れによる再配置(jiggling)といった特徴的な柔軟性(flexibility)をもつ構造を有している。第1世代NNRTIと交差耐性を示さない理由として、この柔軟性があることで耐性変異獲得後の変形した結合部位にも複数箇所の結合が可能となり、逆転写酵素活性を阻害すると考えられている。Das K, 2004
EFV、NVPに対する代表的な耐性アミノ酸変異にK103Nが挙げられるが、第2世代非核酸系逆転写酵素阻害剤はこの変異を有するHIV-1に対し十分な抗ウイルス作用を示す。Madruga JV, 2007 ; Lazzarin A, 2007 ; TMC125-C223 Writing Group, 2007
NNRTIは単剤で使用した場合、容易に高度耐性を獲得するために、使用され始めた当初は寿命の短い薬剤と予想されていたが、実際に使用されるようになると、長い血中半減期と大変優れた治療効果を発揮し、プロテアーゼ阻害剤に代わり多剤併用療法の要となっている。
プロテアーゼ阻害剤
プロテアーゼ阻害剤(PI=Protease Inhibitor)はウイルス粒子が成熟する段階でペプチドを切断する酵素を阻害する薬剤である。
- saquinavir(SQV)
- ritonavir(RTV)
- indinavir(IDV)
- nelfinavir(NFV)
- fosamprenavir(FPV)
- lopinavir(LPV)
- atazanavir(ATV)
- darunavir(DRV)
<合剤>
- prezcobix(PCXまたはDRV/c)(darunavir+cobicistat [DRV+COBI])
最初に登場した3つのプロテアーゼ阻害剤SQV、RTV、IDVは、それぞれ異なる開発戦略から生み出された。
SQVはphenylalanine-prolineを模倣したhydroxyethylamine isosteres構造を持つ薬剤である。
これはGag p17-p24、Pol p6*-protease, protease-RT間の切断部に見るTyrosine/Phenylalanine-Proline配列がHIV-1プロテアーゼに特異的で、哺乳類のアスパラティックプロテアーゼでは認識・切断できないことを応用したものである。
これに対して開発の基盤となったのは、同じアスパラティックプロテアーゼであるレニンに対する薬剤開発戦略である。
レニン阻害剤開発では本来の基質を模倣した化合物を阻害剤の候補としたが、HIV-1プロテアーゼにおいても同様に本来の基質であるGagタンパクの切断配列を模倣した化合物が取り上げられた。
その結果hydroxyethylamine isosteres構造を持つ化合物IDVが生み出された。
このように1995年末から1996年にかけて登場したプロテアーゼ阻害剤のうち、SQVとIDVの2化合物は開発戦略が異なっていたにもかかわらず、いずれもhydroxyethylamine isosteres構造をもつ化合物にたどり着いたことは興味深いことである。
これに対してRTVは結晶構造解析から得られたプロテアーゼ活性中心部の構造を基に設計された薬剤である。
プロテアーゼの基質を結合するS1-S1’が活性中心に対して対称構造をとっていることから、切断部を境にP1-P1’に相当する部位が対称になるように薬剤の設計が行われた。
これ以降のプロテアーゼ阻害剤は大まかにSQV・IDVのhydroxyethylamine isosteres系とRTVのsymmetrical inhibitor系の2つに分類することができる。初期の3剤の登場以降、新たなプロテアーゼ阻害剤の開発には、
- 高い経口吸収性
- 長い血中半減期
- 低いタンパク結合率
- 交叉耐性のない薬剤耐性プロファイル
が求められるようになった。
1997年に登場したNFVは、SQVとC末側半分は全く同じ構造をもつ薬剤である。
SQVとの違いはN末側の構造を小さくしたことであり、これにより経口吸収性の改善に成功した。また他のプロテアーゼ阻害剤とは異なるNFVに特有の耐性変異D30NとN88Dを誘導することとなった。
FPVとAPV(amprenavir)もまたhydroxyethylamine isosteres系列の薬剤である。
まず1999年にAPVが認可されたが、経口吸収性に問題があり、あまり使用されなかった。
2004年になり経口吸収性を改善させたpro-drugのFPVが登場した。
FPVは腸管上皮においてalkaline phosphataseにより、APVに変換されて吸収される。
LPVはRTVが基になって作り出された薬剤である。
開発に当たってはRTVの耐性変異である82番の変異誘導を回避する様に設計された。
その結果LPVは特異的な耐性変異を誘導せず、耐性変異の集積数が耐性度を左右するユニークな薬剤耐性プロファイルを持っている。
最近登場してきたのがATVであり、ATVもRTV、LPV同様にP1-P1’の対称性を念頭に開発された薬剤である。
ATVは大変優れた経口吸収性を示し、血中の薬剤半減期も長いことから、1日1回の服用が可能な薬剤である。
また薬剤耐性HIV-1のプロファイルも既存のPIとは異なり、初回治療に失敗した症例ではI50Lが100%の確率で認められた。
I50LはATVに特徴的な変異であり、他のPIに対してはほとんど影響しないことが知られている。
また1~2剤のPIに対して耐性を獲得したウイルスであれば、十分ATVの効果が期待される。
最近登場したDRVは、bis- THFとsulfonamide isostereを基本構造にもつAPVと構造学的に類似しており、既存のPIが効かない多剤耐性を示すウイルスに対しても高い抗ウイルス効果を示す薬剤である。Koh Y, 2003 ; De Meyer S, 2005
DRVのbis-THFはプロテアーゼ活性中心のAsp29とAsp30に強固に結合し、その結合親和性は既存のPIより約100倍も高いとの報告もある。Dierynck I, 2007
この活性中心への高親和性がDRVの耐性変異の誘導を極めて低くしていると考えられている。
インテグラーゼ阻害剤
インテグラーゼ阻害剤(INI=Integrase Inhibitor)はHIV遺伝子の宿主遺伝子への「組み込み」を担う酵素を阻害する薬剤である。
- raltegravir(RAL)
- elvitegravir(EVG)
- dolutegravir(DTG)
<合剤>
- Stribild(STB)(elvitegravir+cobicistat+tenofovir+emtricitabine [TDF+FTC+EVG+COBI])
- Genvoya(GEN)(elvitegravir+cobicistat+tenofovir alafenamide+emtricitabine [TAF+FTC+EVG+COBI])
- Triumeq(TRI)(dolutegravir+lamivudine+abacavir [3TC+ABC+DTG])
インテグラーゼはHIVの複製に欠かせない酵素の一つであり、HIV遺伝子断端を組み込み反応の基質として活性化処理する3’プロセッシング活性(3́-processing)と組み込み酵素活性(Strand transfer)の2つの酵素活性を有していることが知られている。Engelman A, 1991
2000年にMerchの研究グループにより、ジケト酸骨格をもつ化合物が、インテグラーゼの組み込み活性を阻害することが初めて報告された。Hazuda DJ, 2000
その後、臨床使用に耐えうるように薬物代謝や毒性等の問題を解決するには、さらに10年近い歳月が費やされ、2007年米国において世界初のインテグラーゼ阻害剤としてRALが認可された。Markowitz M, 2006
第1世代インテグラーゼ阻害剤(RAL、EVG)
インテグラーゼ活性中心に存在する2つの金属イオンをキレートすることにより、酵素活性を阻害する。そのため、第1世代インテグラーゼ阻害剤に対するほとんどの耐性変異は、この活性中心周辺に誘導される。
RALの耐性変異出現経路は大別して3つあり、①Y143C、②Q148R/H/K、③N155Hが主要耐性変異として知られている。Hicks C, 2009; Hurt CB, 2014
一方EVGについては、上記の②Q148R/H/K、③N155Hに加え、T66I、E92Qも耐性を示すことが知られている。Shimura K, 2008
いずれの主要耐性変異もHIVの増殖能力を著しく低下させることが知られており、その機能を補い、耐性度を上昇させるために副次変異を伴っていることが多い。例えば、Q148R/H/KはG140S/AやE138K/Aを、N155HはL74MやE92Q、T97Aなどを伴い、薬剤耐性ウイルスはこのいずれかの経路で選択されていくと報告されている。Malet I, 2008
第2世代インテグラーゼ阻害剤(DTG)
カルバモイルピリドン骨格を有しており、第1世代インテグラーゼ阻害剤と同様、酵素活性中心の金属イオンをキレートする。またウイルスDNAの末端にも相互作用する。そのためこの薬剤は酵素から乖離しにくく活性中心に強固に結合するため、強力な抗ウイルス活性を示す。Hightower KE, 2011
DTGの特徴的な耐性プロファイルとして、第1世代インテグラーゼ阻害剤と比べ酵素活性中心近傍のアミノ酸の側鎖との相互作用が少ないため、たとえ変異を獲得してもその影響を受けにくい。つまり、Y143CやN155Hといった第1世代インテグラーゼ阻害剤に対する耐性変異を有するウイルスに抗ウイルス効果を発揮する。しかしながらQ148R/H/Kに副次変異を伴った場合、DTGに対し感受性低下を示すことが知られている。Seki T, 2015
インテグラーゼ活性中心以外の耐性変異では、in vitroでのDTG耐性誘導試験とin vivoでウイルス学的失敗症例から、C-terminal domain(CTD)からR263Kがそれぞれ検出されている。しかしながらその耐性度は報告論文によって異なり、2-8倍程度である。Wainberg MA, 2015
CCR5阻害剤
HIV-1のタンパクあるいは酵素ではなく、宿主細胞のケモカインレセプターを標的にした薬剤である。CXCR4あるいはCCR5を標的にしたものが開発されている。
日本では2008年12月25日にMaraviroc(マラビロク)が認可されている。
- Maraviroc
